くすりの一生
薬の開発、承認、製造から製造販売後まで
- 薬の開発には複雑なプロセスを経る長い時間と莫大な費用が必要です。また、1つの薬を作るのに約70万個もの候補化合物の評価をしていかなければなりません。そして、そのうちの1つが患者さんに届くわけです。ここでは、新薬の候補化合物の研究開発から製品となって患者さんのもとに届くまで、さらには医師が患者さんに薬を処方してからどのように薬に関わっていくのかを示します。いわゆる製薬企業が製品ライフサイクルと呼ぶ「くすりの一生」について解説します。
「くすりの一生」はこちらから
- このプロセスの中には、製薬企業などが企業単独で行う場合もありますが、大学や医療機関などの研究機関との連携により成果が生み出される場合もあります。大学や医療機関との連携による研究を着実に進め、その成果として新しい薬が創出されるために、企業が資金を提供することもあります。どのような費用を提供しているのか、以下の図に提示しています。また、例示可能な項目については「製品ライフサイクル」の各プロセス内で説明しています。
- 更に、「製品ライフサイクル」内の各プロセスは、様々な法律と自主規制を順守して進行管理されています。複雑と言われる創薬から新薬の製造販売後に至るプロセスと順守すべき法律や規制についても説明します。下記の図は製品ライフサイクルの一部をお示ししています。
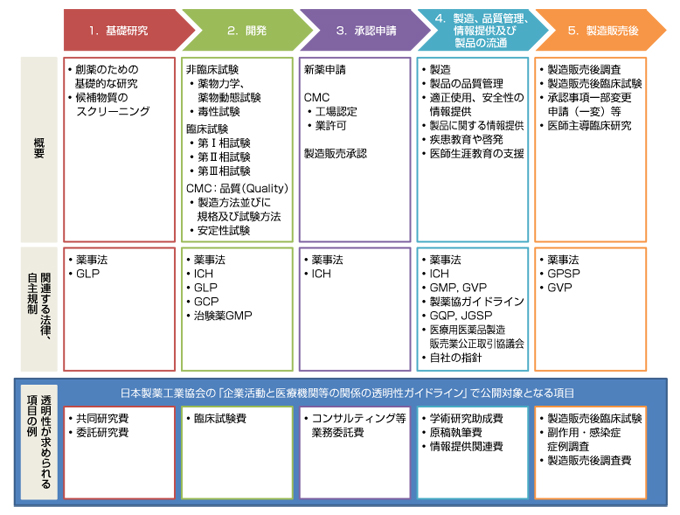
製品ライフサイクルと各プロセスの法律等に関する用語の説明
- 「医薬品,医療機器等の品質,有効性及び安全性の確保等に関する法律(医薬品医療機器等法)」 The Law on Securing Quality, Efficacy and Safety of Products including Pharmaceuticals and Medical Devices
日本における医薬品、医薬部外品、化粧品及び医療機器に関する製造、販売、基準・検定、取扱い、広告規制などの規定に加え、医薬品、医療機器等の安全かつ迅速な提供の確保を図るため、添付文書の届出義務の創設、医療機器の登録認証機関による認証範囲の拡大、再生医療等製品の条件及び期限付承認制度の創設等の所要の措置を講じた法律(施行期日:平成26年11月25日)。
- GLP:Good Laboratory Practice
医薬品の安全性に関する非臨床試験の実施の基準。非臨床試験における動物試験に関する基準で、とくに毒性試験についての基準を定めたもの。
- CMC:Chemistry, Manufacturing and Control
申請書類における原薬・製剤の、Chemistry(化学)・Manufacturing(製造)・Control(品質管理)の情報のこと。CMCは、原薬プロセス研究と製剤開発研究、それに品質評価研究を統合した概念で、これらに関する仕事全般のことを指す。製薬企業におけるCMC部門は、非臨床試験、臨床試験から申請までに関わる幅広い業務を担っていることが多い。
- GCP:Good Clinical Practice
医薬品の臨床試験の実施に関する基準。
- ICH:International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use
日米EU医薬品規制調和国際会議。新薬承認審査の基準を国際的に統一し、医薬品開発の効率化と迅速化を促進することを目的とする。
- GMP:Good Manufacturing Practice
医薬品及び医薬部外品の製造管理及び品質管理の基準に関する省令。医薬品等の製造所における製造管理、品質管理の基準のこと。
- PV:Pharmacovigilance
ファーマコビジランス。医薬品の安全性監視に関する活動。製造販売承認を取得した製品は、その製品を供給している期間は安全性に関して注意深いモニタリングと継続した調査を実施する。
- GQP:Good Quality Practice
医薬品などの品質管理の基準
- GDP:Good Distribution Practice
医薬品物流に関する基準。
- GPSP:Good Post-marketing Study Practice
医薬品製造販売後調査・試験の実施の基準
- GVP:Good Vigilance Practice
医薬品などの製造販売後の安全管理基準。
